Experimentos caseros. Diviértete con cientos de experimentos fáciles de realizar, experimentos para secundaria, experimentos para niños...
Como hacer experimentos para niños
Experimentos cientificos para niños gratis
Como hacer baterías caseras
Inventos para niños
Experimentos caseros taringa
Experimento de química
Experimentos de química
La Vela que Hace Subir el Agua – Combustión
Objetivos:
En estos experimentos de fisica tendremos como objetivo explicar el proceso de la combustión en presencia y ausencia del aire.
Fundamento Teórico:
La Combustión: Esta palabra encierra un complejo proceso donde el oxígeno es la sustancia necesaria para que se produzca. En realidad toda combustión es cambio químico por el cual los átomos de las sustancias llamadas "combustibles" se combinan con el oxígeno que hay en el aire .Si comparamos el principio de la combustión de un motor con respecto ala digestión de alimentos ,la diferencia la radica en el tipo de "combustible "utilizado (no es lo mismo un vaso de leche o un churrasco, que un vaso de la mejor nafta sin plomo o un leño de algarrobo),pero fundamentalmente, la velocidad en que transcurren ambas reacciones es diferente. En el proceso digestivo se libera energía según se requiera. Y en el caso de combustible fósil, la reacción se mantiene por sí sola una vez que ha comenzado.
Materiales:
- 1 vela
- 3 monedad
- 1 vaso transparente
- 1 plato hondo con agua
Procedimiento:
1. Pega la vela con su misma cera en el centro del plato.
2. Al plato ponle agua, más o menos tres centímetros de alto, y acomoda las monedas sobre las que apoyarás el vaso.
3. Prende la vela y pon el vaso boca abajo, sobre las monedas, cubriéndola, cuidando que pueda pasar el agua adentro del vaso.
4. Observa
Conclusiones:
¿Qué pasó?
La vela se apaga a los pocos segundos de haberla tapado con el vaso. El nivel del agua sube
adentro del vaso.
La vela se apaga en cuanto se termina el oxígeno. Durante la combustión se consume el oxígeno y se desprende carbono de la vela formando dióxido de carbono. Una vez que se enfría, el aire con dióxido de carbono estará a una presión menor, por lo que el agua fluye hacia esa zona.
Aplicaciones Practicas:
Si aíslas algo que se está quemando puedes evitar que siga quemándose, por ejemplo se recomienda cubrirlo con una cobija de lana. Tal vez hayas observado que algunos curanderos ponen una vela en la espalda del enfermo y colocan un vaso sobre ella, la piel es succionada en cuanto se apaga la vela. Esto es un fenómeno físico muy llamativo.
En la Naturaleza:
Vientos y corrientes marinas, Hay muchos factores que influyen en el movimiento de los fluidos (como el aire y el agua), entre estos factores están los cambios en la temperatura y la presión. Los fluidos calientes tienden a subir y a desplazar a los fluidos fríos los cuales tienden a bajar. El aire se desplaza de las áreas de mayor a menor presión formándose de esta manera los vientos y las corrientes marinas.
Las Bacterias y la leche
Objetivos:
En estos experimentos caseros tendremos como objetivo observar las impurezas de diferentes muestras de leche usando el compuesto llamado: Azul de metileno.
Fundamento Teórico:
Contaminación de la Leche: Los microorganismos pueden encontrarse en todo lugar: en los animales, en la gente, en el aire, en la tierra, en el agua y en la leche. Una leche de buena calidad, segura para consumo humano, es el resultado de reconocidas prácticas sanitarias observadas a lo largo de todas las etapas del proceso, desde la extracción de la leche hasta su envasado.
El número de bacterias presentes en el producto final refleja las condiciones sanitarias bajo las cuales la leche ha sido procesada y permite determinar el periodo de preservación de ésta o de sus derivados. Las principales fuentes de contaminación en la leche cruda por presencia de microorganismos están constituidas por superficies tales como las ubres del animal y los utensilios.
Durante el manipuleo, las manos también portan bacterias a la leche. Por ello, resulta sumamente importante lavar cuidadosamente las manos y las superficies con agua limpia. Las mejoras en las prácticas sanitarias durante el manipuleo y el procesamiento tradicional de la leche pueden no ser bien recibidas debido a las creencias culturales o, simplemente, a la falta de tiempo. Se requiere desarrollar talleres de capacitación para demostrar en la práctica el efecto de las buenas técnicas sanitarias en la calidad del producto final.
Materiales:
- Frascos Limpios
- Diferentes muestras de leche
- Gotero
- Azul de metileno
Procedimiento:
1. Colocar una muestra de la misma cantidad de leche en cada frasco
2. Agregar 5 gotas de azul metileno en cada muestra
3. Agitar suavemente para que el colorante se disuelva homogéneamente
4. Observar las diferencias de coloración en cada tubo.
Conclusiones:
Esta prueba para determinar impurezas en la leche se llama: la prueba de la acidez, se puede estimar la cantidad de microorganismos, inocuos o patógenos, que hay en un mililitro de leche.
El reactivo es solución alcohólica de azul de metileno. Después de añadido, se agita suavemente el líquido midiendo con un cronómetro el tiempo necesario para su decoloración. Cuanto menor es el tiempo de decoloración, mayor es la contaminación.
Video:
En este video se explican otros métodos para calcular la calidad de la leche.
En el minuto 1:24 estará la prueba que hemos realizado, la prueba de la acidez.
Oxidacion de Alimentos
Objetivos:
El objetivo de estos experimentos caseros es hacer que una reacción química se produzca más lentamente que en circunstancias normales.
Fundamento Teórico:

Un antioxidante es una molécula capaz de retardar o prevenir la oxidación de otras moléculas.
Materiales:
- Una manzana
- Un cuchillo
- Una cuchara
- Zumo de limón
- Una bolsa de plástico
- Hielo
Procedimiento:
1) Tomamos una manzana sin pelas y lo cortamos en cuatro partes
2) A una de la partes lo envolvemos con el plástico
3) A la otra de las partes lo rociaremos por su parte cortada con zumo de limón
4) Al ultimo pedazo lo pondremos junto al hielo
5) Al cabo de unos minutos se observara que las partes de las manzanas van perdiendo su color característico, unas mas rápidas que otras.
Explicación:
La oxidación de la fruta puede retardarse debido a diferentes factores: Por refrigeración o envolviéndola con un plástico para que el oxigeno no entre en contacto con la fruta.
Al entrar en contacto con el oxigeno atmosférico comienzan a oxidarse ciertas sustancias presentes en la manzana, formándose productos de color marrón. En el caso de la manzana “protegida” por el limón, el acido cítrico de este actúa de catalizador ralentizado, de manera que esas reacciones de oxidación se producen a una velocidad mucho menor.
Por su acción ralentizadora de muchos procesos de degradación bioquímica, no es extraño que el acido cítrico se utilice como conservante en muchos alimentos preparados.
Si se quiere observar es una reacción acelerada basta verter agua oxigenada en dos vasos y añadirle a uno de ellos un trocito de patata cruda y pelada: mientras que en el vaso que contiene solo agua oxigenada apenas se aprecia nada, en el otro se observa un burbujeo intenso. En este vaso se está produciendo la descomposición del agua oxigenada -en agua y oxigeno- de forma muy rápida debido a la acción catalítica de una sustancia presente en la pulpa de la patata.
Descomposicion del Color Negro
Objetivos:
En estos experimentos caseros observaremos experimentalmente la descomposición de los colores, ayudándonos de la cromatografía
Fundamento Teórico:
La tinta negra generalmente está formada por una mezcla de pigmentos de diversos colores. En esta experiencia utilizaremos una técnica habitual en los laboratorios para separar mezclas de distintas sustancias: la cromatografía.
Esta técnica se basa en las distintas velocidades con las que se mueven las sustancias (en nuestro caso los pigmentos de la tinta) en un medio poroso (el papel) cuando son arrastradas por un solvente en movimiento (el agua).
Materiales:
- Agua
- Papel de filtro
- Marcador al agua color negro
- Vaso de plástico para café
Procedimiento: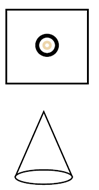
1. Cortar del papel de filtro un cuadrado de 8 x 8 cm y hacerle un orificio al centro.
2. Dibujar con el marcador negro una circunferencia alrededor del orificio central.
3. Cortar otro trozo del papel de filtro de 5 x 3 cm y armar un cono.
4. Introducir la punta del cono por el orificio del papel con la circunferencia dibujada.
5. Agregar en el vaso de plástico agua hasta la mitad.
6. Colocar el conjunto sobre la boca del vaso de café con el cono con la punta hacia arriba (teniendo cuidado que no se salga) y observar qué sucede cuando el agua alcanza la circunferencia.
Explicación:
Cuando la base del cono se sumerge en el agua, ésta comienza a ascender por el papel hasta llegar al orificio. A medida que se va extendiendo a su alrededor, se encuentra con la circunferencia color negro dibujada y arrastra los distintos pigmentos que forman la tinta negra. Como no todos se mueven con la misma velocidad, al cabo de un rato se pueden observar círculos de colores, correspondientes a los distintos pigmentos que se han mezclado para fabricar la tinta negra.
Inflador Quimico
Objetivos:
Realizar reacciones químicas que al desprender gases nos permitan inflar un globo sin la necesidad de soplarlo.
Estos experimentos caseros no causan mayor riesgo, por lo que es aconsejable para niños.
Fundamento Teórico:
Una reacción química es un proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes, llamadas productos.
En una reacción química, los enlaces entre los átomos que forman los reactivos se rompen. Entonces, los átomos se reorganizan de otro modo, formando nuevos enlaces y dando lugar a una o más sustancias diferentes a las iniciales.
Materiales:
- Globo (como el que se usa en los cumpleaños)
- Botella de gaseosa de 500 cm3
- Bicarbonato de sodio (se compra en las farmacias)
- Vinagre
- Cucharita de plástico
Procedimiento:
1. Colocar un poco de vinagre en la botella de gaseosa (hasta llenar 1 cm del fondo).
2. Colocar en el interior del globo una cucharadita bien llena de bicarbonato de sodio.
3. Manteniendo la botella bien derecha para no derramar el vinagre y con cuidado que no caiga el bicarbonato al interior de la botella, ajustar el globo en la boca.
4. Para que se produzca la reacción química entre el bicarbonato de sodio y el vinagre debemos hacer que estas dos sustancias se mezclen. Sosteniendo la botella con una mano, levantar con la otra el globo y agitarlo para que caiga el bicarbonato al interior de la botella.
5. Observar el resultado de la reacción.
Explicación:
Cuando se ponen en contacto el vinagre con el bicarbonato de sodio se produce una reacción química que genera un nuevo producto, en este caso un gas llamado dióxido de carbono, que es el responsable que el globo se infle.
El dióxido de carbono es el mismo gas que se encuentra en todas las bebidas gaseosas y espumantes. También lo producimos nosotros en nuestro organismo durante el proceso de la respiración.
Expansion y Compresion de Gases
Objetivos:
El objetivo principal de estos experimentos de quimica es analizar la expansión y contracción térmica de los gases, en este caso del aire.
La idea es lograr un globo mágico que se infle y se desinfle solo. Puedes conseguir el efecto tantas veces como quieras. Espero que estos experimentos caseros sean de utilidad para ustedes.
Fundamento Teórico:
Los globos aerostáticos vuelan porque el aire caliente se expande hasta que pesa menos que el aire que lo rodea. Los buzos respiran bajo el agua gracias al aire comprimido que está en un tanque, es decir mucho aire en poco espacio.
Los gases pueden cambiar su volumen por un cambio de la temperatura o de la presión. A más temperatura y menos presión ocupan mayor volumen.
Materiales:
- Botella de plástico
- Globo
- 2 recipientes
- Agua caliente
- Agua fria con hielo
Procedimiento:
1) Tapa el cuello de la botella con el globo.
2) Llena uno de los recipientes con agua caliente y el otro con agua fría.
3) Pon la botella dentro del recipiente con agua caliente y después pásalo al que contiene agua fría.
4) Observa lo que sucede
5) En uno de los dos casos se infla el globo, en el otro se desinfla.
Explicación
El aire es un gas, y como todos ellos se expande con el aumento de la temperatura y ocupa más espacio.
Por el contrario con el recipiente frío se comprime y ocupa menos espacio. Nota que es la misma cantidad de aire.
El experimento puede fallar si hay fuga de aire entre el globo y la botella, y también si la diferencia de temperatura no es suficiente para cambiar notablemente el volumen del aire dentro de la botella.
Video Demostrativo
Pilas Caseras Usando Vinagre y Sacapuntas – Electroquimica
Objetivos:
Fundamento Teórico:
Materiales:
- Recipiente
- Vinagre
- Sacapuntas de metal
- pedazo pequeño de cobre
- Cables eléctricos delgados
- Led
Procedimiento:
1) Montar el circuito como se muestra en la figura:
Explicación:
Video Demostrativo:
Limpieza de Objetos de Plata
Muchas veces estamos en la necesidad de limpiar objetos de plata, comenzaremos explicando que la plata se oscurece al estar en contacto con el azufre que esta presente en el aire en forma de sulfuro de hidrogeno, de esta forma la plata pierde su brillo y se mancha.
En estos experimentos caseros fabricaremos un limpiador de plata con materiales fáciles de encontrar.
Materiales:
- Un objeto de plata manchado u oscurecido
- Una bandeja forrado con papel aluminio
- Agua caliente
- Sal
- Bicarbonato
Procedimiento:
1) Preparamos una mezcla de agua caliente, sal y bicarbonato.
2) Colocamos dicha mezcla en el recipiente forrado con papel aluminio.
3) Se coloca el objeto de plata dentro del recipiente y se espera unos minutos.

Explicación:
El objeto de plata se limpia gracias a que la reacción quimica dentro del recipiente elimina el sulfuro de hidrogeno del objeto de plata.
Al perder el sulfuro de hidrógeno el objeto recupera su brillo característico. Se observara también que el sulfuro de hidrogeno se deposito en el recipiente, por lo que este se oscurece.